Restrizione calorica e ADPKD
Warner e collaboratori hanno mostrato come una riduzione dell’apporto calorico possa portare grandi miglioramenti nella progressione di ADPKD in modelli murini. Nel loro studio i volumi renali dei topi alimentati con una dieta restrittiva (inferiore del 40% rispetto ai fabbisogni) erano dimezzati dopo 6 settimane. Contemporaneamente si era notato un miglioramento degli indici relativi alle cisti e all’infiammazione e una diminuzione di oltre il 50% dei livelli di fibrosi. Si è evidenziato come i topi con ADPKD avessero maggiori livelli di markers infiammatori come TNF-α e IL-6, tali indicatori diminuivano raggiungendo i livelli di normalità nei topi sottoposti a restrizione calorica. I marker relativi alla proliferazione cellulare e all’apoptosi apparivano diminuiti in modo significativo grazie alla restrizione calorica. La soppressione di tali indici è probabilmente uno dei meccanismi chiave tramite cui la restrizione calorica ha una forte azione positiva nell’ambito dell’ADPKD. Infine, gli autori riferiscono che tale dieta, iniziata più tardi rispetto all’insorgenza della malattia, porta ad un miglioramento simile a quello osservato trattando gli animali prima della comparsa delle cisti, questo suggerisce come la restrizione calorica possa potenzialmente ripristinare i danni della malattia policistica renale. I limiti dell’applicazione di questa possibile strategia sugli esseri umani sono sicuramente la compliance nei confronti della importante restrizione calorica; il tentativo della ricerca è quindi quello di trovare delle molecole che possano mimare gli effetti di tale riduzione calorica.
Metabolismo del glucosio e ADPKD
Lavori recenti hanno dimostrato come il gene PKD1 sia implicato nel metabolismo del glucosio, aprendo nuove strategie terapeutiche. Il metabolismo del glucosio prevede tre fasi: glicolisi, ciclo di Krebs e fosforilazione ossidativa. Nella glicolisi il glucosio viene convertito in piruvato con la formazione di energia sotto forma di adenosina trifosfato (ATP). In carenza di ossigeno però, il piruvato prodotto non può essere indirizzato alle due fasi successive e viene convertito in lattato generando una minima quantità di ATP. In alcune condizioni di iper-proliferazione cellulare come certi tumori, l’inibizione dell’attività mitocondriale si registra anche in presenza di buona ossigenazione e viene definito glicolisi aerobia o effetto Warburg.
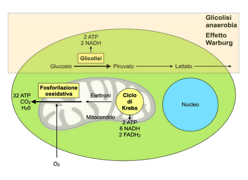
Nel 2013 uno studio condotto da Rowe e collaboratoriha dimostrato come in cellule di topo in cui è stato inattivato il gene PKD1, ci sia un incremento dell’assorbimento di glucosio e un incremento dei livelli di lattato e ATP. Questo evidenzia come la glicolisi aerobia sia la via preferenziale con cui le cellule con PKD1 mutato soddisfano il proprio fabbisogno, proprio come accade nel caso delle cellule tumorali. La scoperta che l’effetto Warburg sia presente anche nella malattia policistica renale apre prospettive interessanti. Infatti, dato che il gene PKD1 è implicato nella regolazione della glicolisi aerobia, l’utilizzo di molecole che interagiscono con questa via metabolica può essere un approccio terapeutico per rallentare la progressione di ADPKD. Sulla base di quanto dimostrato è stato somministrato a modelli di ratti con PKD1 mutato il 2-desossi glucosio, un analogo del glucosio che interferisce con la glicolisi sostituendosi al glucosio. I topi trattati hanno manifestato una riduzione del numero delle cisti renali, del volume totale dei reni e della proliferazione delle cellule adiacenti alle cisti. Questa molecola infatti, competendo con il glucosio, impedisce alle cellule mutate di utilizzare il loro substrato preferito per la proliferazione (6).
In uno studio successivocondotto da un diverso gruppo di sperimentatori su modelli di ratti, il trattamento con 2DG per 5 settimane ha determinato un peso dei reni significativamente più basso (-27%) e una diminuzione dell’indice cistico renale (-48%). La sperimentazione ha anche mostrato una maggiore clearance della creatinina e dell’acido urico e ridotti livelli di albuminuria (8). Allo stesso modo il trattamento cronico con basse dosi di 2DG ha portato ad un rallentamento della progressione della malattia anche in modelli murini con ADPKD lentamente progressiva.
Tutti questi studi indicano che il 2DG limita efficacemente la progressione della malattia policistica renale attraverso l’inibizione della proliferazione delle cellule epiteliali ed il suo profilo di tollerabilità apparentemente positivo, lo rendono un candidato per futuri trial clinici sull’essere umano.
