Per l’epilessia farmaco resistente, ancora oggi non è completamente chiaro quale sia il meccanismo innescato dalla dieta chetogenica tale da determinare gli eventi metabolici in grado di contrastare l’insorgenza delle crisi. In ogni caso, l’efficacia della dieta chetogenica sui pazienti è dimostrata da numerosi studi: almeno il 50% dei pazienti risponde a questa dietoterapia con una diminuzione del 50% nella frequenza delle crisi convulsive. La dieta chetogenica classica è il protocollo più consolidato nel tempo ed efficace per mantenere una chetosi cronica ad alti livelli.
Durante il digiuno, l’organismo si adatta alla carenza di carboidrati circolanti diminuendo la secrezione di insulina ed aumentando quella di glucagone, adrenalina e cortisolo. Si instaura in questo modo un catabolismo che porta alla degradazione dei triacilgliceroli (TAG), glicogeno e proteine immagazzinati durante la fase postprandiale, per mantenere costante la quantità di glucosio circolante, unica fonte energetica per i tessuti glucosio-dipendenti (Leuzzi et al., 2013).
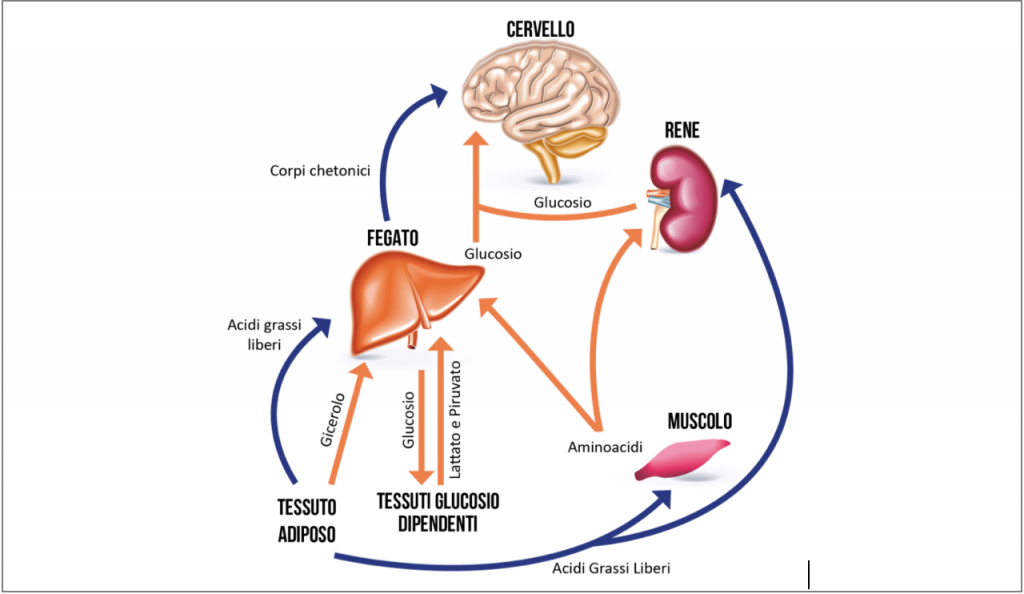
La dieta chetogenica, riducendo l’apporto di glucosio e promuovendo la formazione di corpi chetonici per fini energetici a partire dai lipidi, mima lo stato di digiuno acuto (Wilder, 1921). L’apporto energetico alle cellule periferiche è garantito dall’attività epatica (Leuzzi et al., 2013).
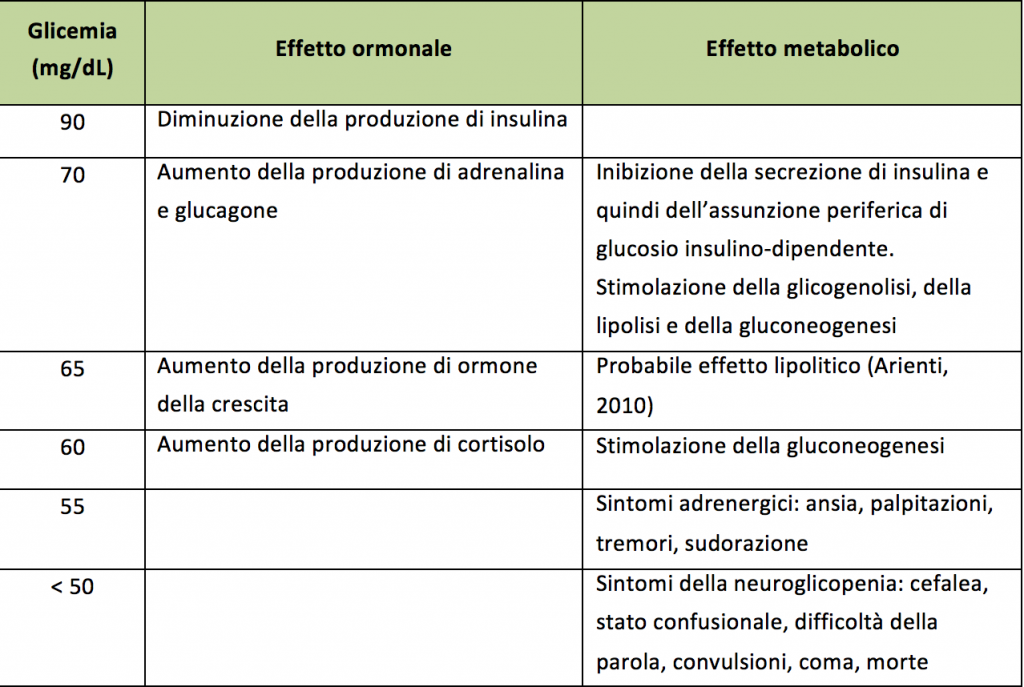
Mimando lo stato di digiuno prolungato, la dieta chetogenica riduce il glucosio ematico e promuove la produzione di corpi chetonici. Numerose sono state le ipotesi per capire come si esplichi l’effetto anticonvulsivante ottenuto con questa nuova situazione metabolica.
I soli cambiamenti ematici di glicemia e chetonemia non sono sufficienti a spiegare il meccanismo di funzionamento della dieta, anche se un ritorno di glicemia e chetonemia a valori pre-dieta può comportare la perdita dell’effetto anticonvulsivante (Masino and Rho, 2012). Studi in vitro e in modelli animali hanno dimostrato che elevati livelli di acetoacetato, beta-idrossibutirrato e acetone hanno una funzione anticonvulsivante su alcuni tipi di crisi, tuttavia i livelli necessari per esplicare quest’effetto non sono mai raggiunti tramite la sola dieta chetogenica (Giordano et al., 2014). Si presume quindi che queste molecole agiscano promuovendo un meccanismo parallelo non ancora identificato (Masino and Rho, 2012).
Il metabolismo dei corpi chetonici produce protoni e quindi un abbassamento del pH che, in vitro e in vivo, ha dimostrato di avere un effetto anticonvulsivante. Tuttavia non è stato dimostrato che la dieta chetogenica riduca in modo significativo il pH cerebrale (Boison et al., 2013).
VARIAZIONI EMATICHE DEGLI ACIDI GRASSI POLINSATURI (PUFA)
L’effetto anticonvulsivante dei PUFA è dovuto all’interazione con i canali voltaggio-dipendenti del sodio, del calcio e del cloro, che porta ad un’inibizione dell’eccitabilità neuronale, e all’attivazione dei recettori PPARα (Peroxisome Proliferator-Activated Receptor) degli astrociti, che inibiscono la trascrizione di fattori pro-infiammatori. Tuttavia gli studi in merito portano hanno portato risultati discordanti (Masino and Rho, 2012).
ALTERAZIONE DELLO STATO ENERGETICO
Studi sugli animali hanno dimostrato che la dieta chetogenica aumenta il rapporto ATP/ADP. Questa alterazione dello stato energetico si accompagna ad un incremento dei processi ATP-dipendenti, come l’attivazione delle pompe del sodio e la captazione dell’acido glutammico extracellulare, che portano rispettivamente all’iperpolarizzazione della cellula e alla riduzione della disponibilità di questo neurotrasmettitore eccitatorio e, di conseguenza, ad una riduzione delle crisi epilettiche (Huffman and Kossoff, 2006).
MODIFICHE DEL TONO ADRENERGICO
La dieta dieta chetogenica potrebbe modificare il tono adrenergico, che sembra essere coinvolto nell’epilettogenesi (Giordano et al., 2014).
AZIONE DI NEUROPEPTIDI E ORMONI PEPTIDICI
Il metabolismo è regolato da una varietà di sistemi neurali e ormonali, tra i quali troviamo peptidi con proprietà anoressizzanti o oressizzanti.
Neuropeptidi e ormoni peptidici sono regolati dal metabolismo, che modifica il loro livello plasmatico e la loro attività durante la chetogenesi. Tutti questi ormoni interagiscono con l’attività sinaptica, inducendo (insulina) o sopprimendo (leptina, grelina, ghrelina deacilata, adiponectina) le crisi epilettiche. Tra questi suscitano particolare interesse la grelina e il suo peptide correlato deacil-grelina, che regolano l’eccitazione dei neuroni con un effetto anticonvulsivante sia nelle scosse mioceniche sia in quelle generalizzate (Giordano et al., 2014).
Il dipartimento di Scienze Biomediche, Metaboliche e Neuroscienze dell’Università di Modena e Reggio Emilia dal 2010, con l’approvazione e il finanziamento del Mistero della Salute e con l’approvazione del Comitato Etico di Modena (RF-2010-2309921), ha attivato uno studio clinico e sperimentale per comprendere se una variazione nei livelli plasmatici dell’ormone gastrico deacil-grelina possa essere coinvolto negli effetti anticonvulsivi e neuroprotetivi dimostrati dalla dieta chetogenica. Studi sviluppatisi nell’ultimo decennio hanno dimostrato infatti che la dieta chetogena modifica l’assetto ormonale mediante la variazione della produzione di ormoni regolatori del metabolismo, come l’insulina ed il cortisolo (Thio, 2012). Tra questi, la grelina, ormone prodotto principalmente nello stomaco, risulta essere tra i principali regolatori del bilancio energetico (Chen et al., 2009). La grelina viene secreta in risposta al digiuno e stimola l’appetito; inoltre stimola la secrezione di ormone della crescita. Lo stomaco poi produce peptidi analoghi alla grelina, come la deacil-grelina, ottenuta anche per deacilazione della grelina in periferia. Sebbene anche la grelina sia secreta durante il digiuno, un numero consistente di studi identifica la deacil-grelina come un possibile segnale a lungo termine degli stati negativi del bilancio energetico, dal momento che la deacil-grelina risulta essere stabilmente aumentata in pazienti affetti da anoressia nervosa o nel digiuno associato a patologie che comportino cachessia (Ogiso et al., 2011).
